Unità cardiovascolari
- Bypass Aorto Coronarico
- Sostituzione valvola mitralica
- Sostituzione Aorta
- Sostituzione valvola aortica
- Ventricoloplastica
Inizialmente tutti i bypass venivano eseguiti suturando un segmento di vena safena (prelevata dalla gamba del paziente) sulla coronaria ostruita; l'altra estremità della vena veniva poi suturata sull'aorta ascendente. Ma i risultati di una rivascolarizzazione di tipo venosa si sono presto rivelati insoddisfacenti: la vena safena può non essere un condotto di buona qualità a causa, ad esempio, della presenza di varici, o a causa della differenza di calibro tra il condotto venoso e la coronaria( questo spiega la ragione per cui alcuni bypass, circa il 10-20% dei casi, si chiudono in tempi precoci), o soprattutto per la alta tendenza che presenta la vena ad ammalarsi di arteriosclerosi ( dopo circa 8 anni il 50% dei bypass si chiudono e quelli ancora pervi presentano una parete a volte più malata della coronaria stessa a cui sono stati suturati). Al fine di aumentare la durata del beneficio dato dall'intervento, nuovi condotti sono stati sperimentati,. All'inizio degli anni '80 venne introdotto l'utilizzo dell'arteria mammaria sinistra (anche detta arteria toracica interna sinistra e che noi da adesso chiameremo LIMA), una arteria decorrente all'interno della cassa toracica subito di fianco allo sterno.
L'intervento di rivascolarizzazione miocardica rimane sempre un intervento di chirurgia maggiore. E sottoponendosi ad intervento, il paziente si espone ad una serie di rischi potenziali la cui probabilità dipende da una serie di fattori legati allo stato generale di salute del paziente. I rischi più comuni comprendono il sanguinamento postoperatorio, le infezioni, l'ictus, l'infarto miocardico perioperatorio, l'insufficienza renale e respiratoria e la morte. I fattori legati al paziente che più influenzano la percentuale di rischio sono rappresentati dall'età, dalla funzione ventricolare sinistra, dallo stato di salute generale e dalla presenza di patologie associate (in particolare vasculopatia periferica, diabete mellito, insufficienza renale e/o respiratoria). Statisticamente un paziente con funzione ventricolare sinistra conservata, in buone condizioni generali e senza patologie associate gravi presenta un rischio operatorio che oscilla tra l' 0.8 e l'1.5%.
Dopo un intervento efficace, il dolore anginoso scompare, anche se per un certo periodo il paziente soffrirà di una certa dolenzia legata all'incisione chirurgica. In genere la dimissione avviene dopo circa una settimana. Il recupero completo può richiedere fino a due mesi dopo l'intervento, perchè nel primo periodo il corpo utilizza la maggior parte delle risorse a disposizione per recuperare dal trauma chirurgico.
Spesso la valvola mitrale può essere riparata con particolari tecniche chirurgiche. La riparazione valvolare mitralica garantisce una migliore performance del muscolo cardiaco, una terapia priva di anticoagulante, una maggiore resistenza alle infezioni.
A volte la valvola mitrale è talmente danneggiata da non poter essere riparata o da non garantire una tenuta duratura della riparazione; in questo caso è necessario eseguire una sostituzione valvolare mitralica.
Il più semplice intervento riparativo è la COMMISSUROTOMIA, cioè la separazione di una anomala fusione dei due lembi tra di loro a livello delle commissure. Questa fusione è causata dalla reazione cicatriziale secondaria alla febbre reumatica, e provoca una stenosi valvolare con tendenza alla progressione. Questa è una tecnica poco utilizzata al giorno d'oggi rispetto al passato in quanto non da buoni risultati a distanza. Più frequenti sono le plastiche valvolari dovute ad alterazioni degenerative della valvola mitrale che comprendono: il Cleft Mitralico, una anomalia congenita associata ad un particolare tipo di difetto interatriale; il Prolasso di uno od entrambi i lembi dovuto ad allungamento o rottura delle corde tendinee; la sindrome della Floppy Valve (letteralmente, la valvola rammollita), in cui tutte le componenti valvolari sono stirate ed allungate; alcuni tipi di endocardite, ed infine alterazioni secondarie alla cardiopatia ischemica (una zona del ventricolo, sede di pregresso infarto, si dilata èstirà verso il basso le corde tendinee di una parte della mitrale: i due lembi non combaciano più perfettamente e la valvola diventa insufficiente. è importante ricordare comunque che in base ai dati preoperatori, il chirurgo può stimare la probabilità che la valvola sia riparabile, ma non può sicuramente garantirlo. Solo dopo aver visto la valvola direttamente ed averne valutato la solidità strutturale il chirurgo deciderà quale strategia adottare nel bene del paziente.
Spesso si tratta semplicemente di una degenerazione a volte associata ad una eccessiva debolezza della struttura dei lembi o delle corde tendinee che ne può causare l'allungamento o anche la rottura. A volte la cardiopatia ischemica, alterando la mobilità delle pareti del ventricolo, può disturbare l'allineamento dei foglietti valvolari e causare una insufficienza mitralica. Malattie come la febbre reumatica può colpire la valvola mitrale, causando la retrazione, fibrosi e fusione dei lembi valvolari. A volte la valvola può essere anche sede di infezione (endocardite) con lo sviluppo di formazioni a cavolfiore denominate vegetazioni.
Nella fase di valutazione preoperatoria si può stimare la probabilità di riparare una valvola disfunzionante, ma non si può garantirne con assoluta certezza l'effettiva riparabilità. Se riparabile, la valvola ha ottime probabilità di durare per un lungo periodo, e questo è soprattutto vero per alterazioni di tipo degenerativo (rottura di corde, prolasso di un segmento di lembo, dilatazione dell'annulus). Statisticamente una valvola riparata ha l'85 - 95% di probabilità di non richiedere un nuovo intervento per i successivi 10 anni. Se la valvola è stata danneggiata dalla febbre reumatica, è possibile che le alterazioni patologiche continuino a progredire anche dopo l'intervento, rendendo la durata della riparazione meno prevedibile. Per questo motivo molti chirurghi sono riluttanti a riparare valvole post-reumatiche. I risultati di plastiche valvolari su alterazioni secondarie a cardiopatia ischemica sono i più difficili di tutti da predire, perchè entra in gioco una altra variabile, cioè la funzione segmentaria del ventricolo sinistro.
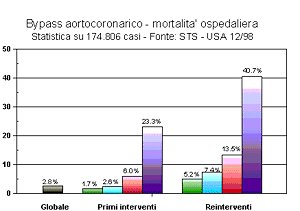
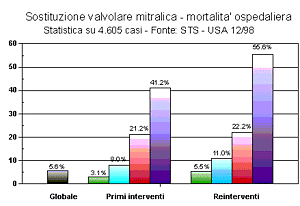
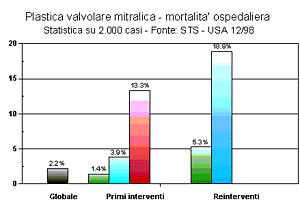
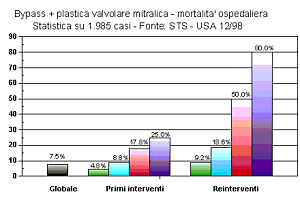
I rischi dell'intervento di sostituzione valvolare mitralica vengono stimati dal cardiochirurgo e dall'anestesista in base ad una moltitudine di fattori. Nei grafici dei risultati sono mostrate le analisi statistiche compiute dalla STS americana su un grande numero di pazienti operati in anni recenti.
Dopo la fase di convalescenza e di riabilitazione, i pazienti operati di ricostruzione valvolare mitralica in genere godono di una importante riduzione della sintomatologia e di un netto miglioramento della capacità d'esercizio e di tolleranza agli sforzi.
Possono essere necessari fino a 2 - 3 mesi dall'intervento per un completo recupero. Dopo la guarigione della ferita sternale (circa 40 gg.), in genere non vi sono limitazioni importanti all'attività fisica.
In linea generale vi sono due tipi di protesi valvolari oggi disponibili, ognuna con pregi e difetti caratteristici: le protesi MECCANICHE e le protesi BIOLOGICHE.
Le protesi valvolari meccaniche sono caratterizzate dall'ottima durata dovuta alla durezza dei materiali che le compongono. Infatti sono costituite da un anello in lega d'acciaio ricoperto di carbonio e da due foglietti mobili anch'essi in carbonio. La durata di una protesi meccanica è teoricamente e praticamente illimitata. Il principale svantaggio di queste valvole è dato dalla necessità di una terapia anticoagulante quoad vitam. Infatti il sangue, a contatto con materiali artificiali tende a formare dei coaguli che potrebbero attaccarsi alla protesi valvolare bloccandone il funzionamento. Il paziente dovrà quindi assumere ogni giorno una certa dose di farmaco anticoagulante e dovrà sottoporsi regolarmente (ogni 3-4 settimane) ad un prelievo di sangue per il controllo del livello di anticoagulazione (se troppo basso, il sangue coagulerà ugualmente, se troppo alto c'è il rischio di emorragie).
Le protesi valvolari biologiche, invece, sono costruite partendo da valvole cardiache (o da altri tessuti come la membrana pericardica) di animali (bovini e suini). Queste valvole richiedono una terapia anticoagulante solo per un breve periodo (in genere 3 mesi). Infatti il sangue non tende a coagulare a contatto con questi tessuti. Il loro principale svantaggio consiste nel fatto che la loro durata nel tempo è limitata, ed è inversamente proporzionale all'età del paziente.
In un paziente giovane (sotto i 40 anni), queste valvole durano 8-10 anni al massimo, mentre in uno anziano possono durare anche 15 anni (in rari casi anche di più).
Questa differenza è data dal metabolismo del calcio, che nel giovane è più attivo mentre nell'anziano è più lento; il calcio tende a depositarsi nei foglietti valvolari causandone l'indurimento e successivamente la calcificazione.
I rischi dell'intervento di sostituzione valvolare mitralica vengono stimati dal cardiochirurgo e dall'anestesista in base ad una moltitudine di fattori.
Dopo la fase di convalescenza e di riabilitazione, i pazienti operati di ricostruzione valvolare mitralica in genere godono di una importante riduzione della sintomatologia e di un netto miglioramento della capacità d'esercizio e di tolleranza agli sforzi.
Possono essere necessari fino a 2 - 3 mesi dall'intervento per un completo recupero. Dopo la guarigione della ferita sternale (circa 40 gg.), in genere non vi sono limitazioni importanti all'attività fisica. è buona norma avere nel portafoglio un cartellino che identifichi la persona come portatore di protesi valvolare cardiaca.
La valvola aortica può ammalarsi per diversi motivi: vi può essere una anomalia congenita che può richiedere la correzione subito, se grave, oppure predisporre ad una degenerazione che avviene più tardi nella vita; oppure vi possono essere delle malattie acquisite che colpiscono la valvola aortica. L'anomalia congenita più frequente è data dalla bicuspidia.
In genere la valvola aortica ha tre lembi valvolari o cuspidi, ma a volte può presentarne soltanto due. Una valvola bicuspide è presente nell'1 - 2% della popolazione, e rappresenta la seconda causa più frequente di alterazione tale da richiedere l'intervento. Queste valvole possono funzionare relativamente bene per molti anni prima di diventare stenotiche (cioè con un orifizio troppo stretto) oppure insufficienti (cioè non più in grado di chiudersi bene).
La causa più frequente di malattia valvolare necessitante la sostituzione è la degenerazione senile. Questo significa semplicemente che la valvola, invecchiando, si indurisce e vi si depositano noduli di calcio che ne impediscono il funzionamento. La seconda causa più frequente è la malattia reumatica, che provoca fusione e retrazione cicatriziale dei lembi, lasciando una valvola allo stesso tempo stenotica ed insufficiente. Altre cause meno frequenti di valvulopatia aortica comprendono le infezioni (dette endocarditi), il prolasso di una cuspide e le malattie dell'aorta stessa, come aneurismi e dissezioni.
Una valvola aortica malata può causare una serie eterogenea di sintomi, che comprendono affaticabilità, dispnea da sforzo, angina pectoris, palpitazioni, vertigini e sincopi.
Quando la valvola è stenotica il ventricolo sinistro deve generare una pressione più alta per spingere il sangue a tutto il corpo. Questo causa ipertrofia (cioè ingrossamento) del muscolo cardiaco, predisponendolo ad aritmie ed allo sviluppo di sintomi di angina. Inoltre il ventricolo non si svuota completamente, e questo ristagno di sangue eventualmente si ritrasmette all'indietro fno ai vasi dei polmoni, causando dispnea (difficoltà di respiro) dapprima da sforzo e poi anche a riposo. Infine, in particolari situazioni il cuore può non riuscire a pompare abbastanza sangue per mantenere normale la pressione sanguigna nelle arterie (in particolare quelle del cervello), e questo causa vertigini e sincopi (svenimenti). Quando invece la valvola è insufficiente, parte del sangue pompato ritorna nel ventricolo sinistro causando un sovraccarico di volume e poi una dilatazione del ventricolo stesso. La dilatazione a lungo andare provoca uno sfiancamento delle pareti e l'insorgenza di sintomi di scompenso cardiaco.
Inizialmente i sintomi sono presenti sotto sforzo, ma col progredire della malattia compaiono per sforzi sempre più lievi ed infine anche a riposo. Questo può causare l'impossibilità a dormire in posizione orizzontale o portare a bruschi risvegli per la difficoltà di respiro. Un altro segno di scompenso è il gonfiore alle caviglie, specialmente alla sera.
I farmaci possono aiutare per un certo periodo ad alleviare i sintomi, ma quando la funzione valvolare decade, il Vostro cardiologo Vi raccomanderà di andare dal cardiochirurgo per programmare l'intervento. Alcuni test (ecocardiogramma, cateterismo cardiaco con coronarografia) aiuteranno a stabilire il momento più adatto per l'intervento e ad escludere eventuali patologie concomitanti (per esempio una coronaropatia).
In linea generale vi sono due tipi di protesi valvolari oggi disponibili, ognuna con pregi e difetti caratteristici: le protesi MECCANICHE e le protesi BIOLOGICHE.
Le protesi valvolari meccaniche sono caratterizzate dall'ottima durata dovuta alla durezza dei materiali che le compongono. Infatti sono costituite da un anello in lega d'acciaio ricoperto di carbonio e da due foglietti mobili anch'essi in carbonio. Questo materiale non si consuma e quindi la durata di una protesi meccanica è praticamente illimitata. Il principale svantaggio di queste valvole è dato dalla necessità di mantenere il paziente sotto terapia anticoagulante per tutta la vita. Infatti il sangue, a contatto con il carbonio (come con qualunque materiale artificiale) tende a formare dei coaguli che potrebbero attaccarsi alla valvola bloccandone il funzionamento. Il paziente dovrà quindi assumere ogni giorno una certa dose di farmaco anticoagulante e dovrà sottoporsi regolarmente (ogni 3-4 settimane) ad un prelievo di sangue per il controllo del livello di anticoagulazione (se troppo basso, il sangue coagulerà ugualmente, se troppo alto c'è il rischio di emorragie).
Le protesi valvolari biologiche, invece, sono costruite partendo da valvole cardiache (o da altri tessuti come la mambrana pericardica) di animali (bovini e suini). Queste valvole richiedono una terapia anticoagulante solo per un breve periodo (in genere 3 mesi). Infatti il sangue non tende a coagulare a contatto di questi tessuti. Il loro principale svantaggio consiste nel fatto che la loro durata nel tempo è limitata, ed è inversamente proporzionale all'età del paziente. In un paziente giovane (sotto i 40 anni), queste valvole durano 8-10 anni al massimo, mentre in uno anziano possono durare anche 15 anni (in rari casi anche di più). Questa differenza è data dal metabolismo del calcio, che nel giovane è più attivo e tende a depositarsi nei foglietti valvolari causandone l'indurimento.
Le protesi biologiche più recenti sono trattate con particolari sostanza chimiche allo scopo di ridurre la deposizione di calcio sulla superifice dei foglietti; questi trattamenti hanno mostrato in studi sperimentali la capacità di aumentarne la resistenza alla calcificazione e quindi la durata. In casi particolari possono essere utilizzati altri tipi di protesi, come gli homograft aortici (prelevati da cadavere umano), oppure si può utilizzare un'altra valvola dello stesso paziente e metterla al posto della valvola aortica malata (intervento di Ross). La decisione sul tipo di valvola da utilizzare viene presa dal team medico tenendo conto dell'età del paziente, delle sue condizioni generali, del suo stile di vita ed anche delle sue preferenze.
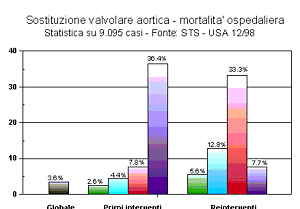
I rischi dell'intervento di sostituzione valvolare aortica vengono stimati dal cardiochirurgo e dall'anestesista in base ad una moltitudine di fattori.
Nei grafici dei risultati sono mostrate le analisi statistiche compiute dalla STS americana su una moltitudine di pazienti operati in anni recenti.
Dopo la fase di convalescenza e di riabilitazione, i pazienti operati di sostituzione valvolare in genere godono di una importante riduzione della sintomatologia e di un netto miglioramento della capacità d'esercizio e di tolleranza agli sforzi. Possono essere necessari fino a 2 - 3 mesi dall'intervento per un completo recupero. Dopo la guarigione della ferita sternale, in genere non vi sono limitazioni importanti all'attività fisica, se non quelle legate all'assunzione di anticoagulanti. è necessaria la profilassi antibiotica prima di ogni procedura invasiva (compresa la rimozione del tartaro dentale), ed è buona norma avere nel portafoglio un cartellino che identifichi la persona come portatore di protesi valvolare cardiaca.
Intervento di sostituzione valvola aortica per calcificazione
Intervento di plastica aortica